
Scribas Tabelle
Scribas Tabelle
Scribas Tabelle der verschreibungspflichtigen Arzneimittel und Medizinprodukte nach bundesrechtlichen Vorschriften
Die Datenbank bietet eine umfassende Liste mit mehr als 2.700 verschreibungspflichtigen Wirkstoffen und Medizinprodukten. Damit deckt sie sowohl die Anwendung bei Menschen als auch bei Tieren ab. Für die praktische Verwendung sind die gängigen verschreibungspflichtigen Medikamente aufgeführt, und die jeweiligen Stoffe, die sie enthalten.
-
INN-Name
-
gebräuchliche Synonyme
-
Kennzeichnung als BtM
-
ATC-Code
-
Monographieeintrag in DAB, HAB oder Ph. Eur.
-
Auswahl an Fertigarzneimitteln
-
Strukturformeln
-
Datum der Verschreibungspflicht oder Änderungsverordnung
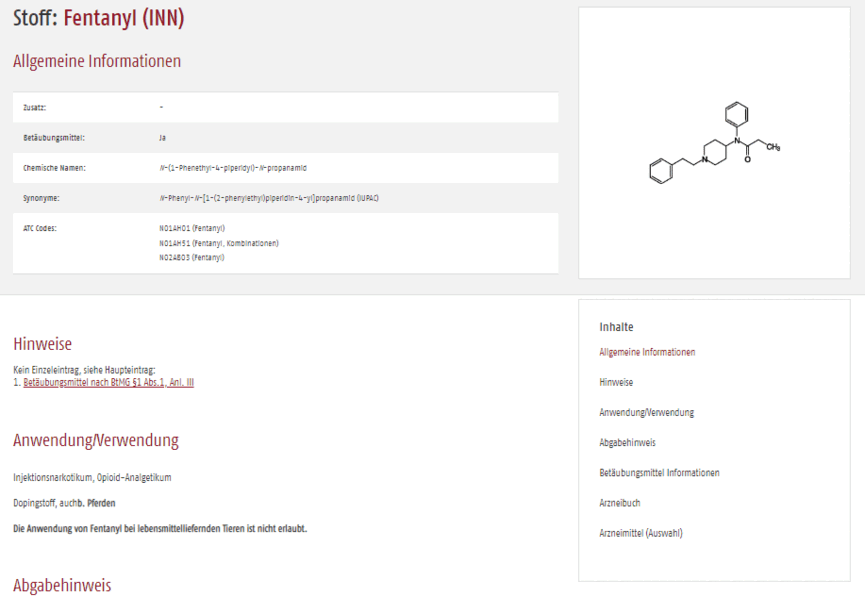
Der Datenbankeintrag in der Scribas Tabelle zeigt alle zentralen Eigenschaften des verschreibungspflichtigen Medikaments, hier am Beispiel Fentanyl, auf einen Blick. Die Strukturübersicht bringt Sie schnell zu den benötigten Detailinformationen. Querverweise führen Sie zu Fertigarzneimitteln mit Fentanyl.
Aktualisierung/Stand
- Aktualisierungslieferung 119
- Regelmäßige Updates analog zum Erscheinen des gedruckten Buchs
Datenbank bestellen
Zum Shop der DAV Mediengruppe oder wenden Sie sich für ein individuelles Angbeot an das Team Datenbanken und Software (software@dav-medien.de / +49 711 2582-347)
Scribas Tabelle
Anleitung/Erklärungen
Haben Sie Fragen?
Sollten Fragen offen bleiben, kontaktieren Sie uns gerne. Das DrugBasePlus-Team hilft Ihnen gerne weiter.
Team Datenbanken und Software
+49 711 2582-347
+49 711 2582-347
montags bis donnerstags
von 9.00 bis 16.30 Uhr, freitags von 9.00 bis 15.30 Uhr
von 9.00 bis 16.30 Uhr, freitags von 9.00 bis 15.30 Uhr